Все услуги и цены / Эстетическая косметология / Плазмолифтинг / Выпадение волос
Плазмолифтинг.
Лечение выпадения волос.
Плазмолифтинг — самая эффективная современная методика для остановки выпадения волос и возобновления роста волос. Уже через 1-2 недели после первой процедуры хорошо заметен положительный эффект. Процедура выполняется в день посещения. Занимает 1 час. Абсолютно безопасна. Подходит всем.
Преимущества Клиники Идеал:
- Опыт выполнения — 7 лет.
- Выполнено — 3000 процедур.
- Стерильная чистота и тщательное соблюдение технологии.
- Оборудование — США.
О применении плазмолифтинга для лечения облысения Подробнее →
Схема проезда
Плазмолифтинг ( PRP - терапия, инъекционная форма богатой тромбоцитами плазмы)
В статье представлен новый метод лечения выпадения волос на основе местного применения аутоплазмы с увеличенным содержанием тромбоцитов. После процедур введения аутоплазмы с увеличенным содержанием тромбоцитов авторы получили улучшение состояния волос, уменьшения выпадения и рост новых волос.
Abstract: The new method of treatment of alopecia is presented. This type of treatment includes the autoplasma injections in to the scalp. After the procedures hair grow is observed.
Введение.
По данным статистики ВОЗ 66% мужчин и 38% женщин во всем мире страдают той или иной формой облысения.
Облысение одна из самых распространенных проблем, связанных с функциональным состоянием организма. Как правило, является проявлением хронических заболеваний и результатом перенесенных острых инфекций, кроме того, длительная лекарственная терапия впоследствии также может вызвать выпадение волос. Однако, до сих пор до конца не ясен патофизиологичесий аспект выпадения волос [2].
Алопеция - это патологическое выпадение волос, приводящее к их поредению или полному исчезновению в определенных областях головы или туловища.
В МКБ – 10 болезни волос кодируются с L-63 по L-67.
Согласно современной классификации различают:
I. Гнездная алопеция
II. Андрогенетическая алопеция
III. Андрогенная алопеция
IV. Диффузная алопеция.
Все они относятся к нерубцовым видам и возникают без предшествующего поражения кожи.
Рубцовые алопеции, в свою очередь, обусловлены воспалением, рубцеванием, атрофией кожи головы [3].
Гнездная алопеция встречается в последнее время достаточно часто. Внешне она обозначена очагами облысения и может располагаться на волосистой части головы, бровях, бороде или туловище. Основными причинами гнездной алопеции являются сильные стрессы, сопутствующие инфекции, заболевания желудочно-кишечного тракта, патология нервной системы, черепно-мозговые травмы.
Андрогенетическая алопеция - наиболее часто встречающийся тип облысения. Распространена среди мужчин, и лишь 10% женщин страдают этим типом облысения. Развитие этого вида алопеции обусловлено генетически, благодаря повышенной чувствительности рецепторов волосяных фолликул к андрогенным гормонам. При этом важно отметить, что содержание андрогенов в крови (мужских гормонов) чаще всего в пределах нормы. Термин «андрогенетическая алопеция» был введен в 1988 г. [1].
Андрогенный тип облысения. Данный тип алопеции отличается от андрогенетической алопеции, он относится к другому типу облысения. Андрогенетическая алопеция имеет наследственный механизм с участием андрогенов, а данный тип возникает исключительно по причине гормональных нарушений. Преимущественно страдают женщины, но мужчин не намного меньше, в процентном соотношении женщины 60%, в то время как мужчины 40% [2].
Диффузные алопеция. Чаще всего это выпадение волос распределяется равномерно по всей волосистой части головы. Среди причин необходимо отметить стресс, диету, проблему щитовидной железы, снижение иммунитета, смену климата, послеродовые процессы у женщин [3].
Чем бы ни была вызвана алопеция, это заболевание требует практически беспрерывных усилий по лечению, с весьма скромными результатами. Во многих случаях качество и количество волос не восстанавливалось, в особенности у мужчин и лиц пожилого возраста. Облысение удавалось лишь несколько замедлить, но процесс истончения волос и отмирания волосяных луковиц неизменно продолжался.
Проблема лечения алопеции в современном мире является одной из ведущих, так как по данным ВОЗ количество людей с облысением все время растет.
В качестве нового и безопасного биологического стимулятора мы предлагаем внутрикожную и подкожную инфильтрацию богатой тромбоцитами аутоплазмы (БоТП).
Впервые мы применили данный метод в 2005 году при лечении фотодерматоза кожи [5].
Роль богатой тромбоцитами аутоплазмы в регенерации тканей.
Оптимизация и ускорение регенерации ран является обязательным условием различных хирургических вмешательств. В 1980-х годах прошлого столетия при рассмотрении процессов заживления ран основное внимание уделяли роли оксигенации тканей [5]. Вне всяких сомнений, оксигенация тканей остается фундаментальным фактором заживления, поскольку она улучшает фагоцитарную и бактерицидную способность иммунных клеток организма и поддерживает синтез коллагена и других белков. Также в регенерации тканей важное значение имеет среда, где протекает реакция. Этой средовой фазой как для нормофизиологических, так и для воспалительных реакций является вода [6].
Важнейшую роль в понимании роли тромбоцитарных белковых факторов, сыграло открытие того факта, что влияние на макрофаги кислорода вообще и напряжения кислорода, в частности, реализуется опосредовано через факторы ангиогенеза и другие факторы роста, которые способствуют заживлению и противостоят инфицированию [10 - 13].
В настоящее время исследования, посвященные процессам заживления, направлены в основном на идентификацию участвующих в них факторов роста, выяснение механизма их действия, а также возможностей их использования для улучшения заживления ран [13–15].
Получение БоТП включает отделение и концентрацию тромбоцитов и, таким образом, содержащихся в них факторов роста. Упрощенно говоря, стратегия применения БоТП состоит в улучшении и ускорении процессов, вызываемых содержащимися в тромбоцитах факторами роста.
Кроме того, БоТП модулирует и регулирует функцию первичных факторов роста в присутствии вторичных и третичных. Упомянутое свойство отличает факторы роста богатой тромбоцитами плазмы от рекомбинантных факторов роста, каждый из которых отвечает за отдельный механизм регенерации [9].
Важнейшие факторы роста тромбоцитов (PRP – factors).
Факторы роста – полипептиды с молекулярной массой 5-50 кДа, объединенные в группу трофических регуляторных субстанций. Подобно гормонам, эти факторы обладают широким спектром биологического действия на многие клетки – стимулируют или ингибируют митогенез, хемотаксис, дифференцировку.
В отличие от гормонов, факторы роста, как правило, продуцируются неспециализированными клетками, находящимися во всех тканях, и обладают эндокринным, паракринным и аутокринным действием.
К важнейшим факторам роста относятся тромбоцитарный фактор роста (PDGF-aa, PDGF-bb, PDGF-ab), трансформирующий фактор роста (TGF-β1, TGF-β2), фактор роста эндотелия сосудов (VEGF), фактор роста эпителия (EGF), фактор роста фибробластов (FGF), инсулиноподобный фактор роста (IGF).
Эти естественные факторы роста находятся в биологически предопределенных соотношениях. Все это отличает богатую тромбоцитами плазму от рекомбинантных факторов роста. Рекомбинантные факторы роста синтезируются культурой яйцеклеток китайского хомяка, в ядро которых с помощью бактериального вектора введен человеческий ген. В результате продуцируется фактор роста одного типа, который затем применяется без синтетического или естественного носителя.
В течение первых 10 минут тромбоциты секретируют около 70% факторов роста из тех, которые в них находятся. Полное высвобождение факторов роста происходит в течение часа. После этого тромбоциты продолжают синтезировать дополнительное количество факторов роста в течение приблизительно 8 дней, после чего тромбоциты погибают.
Наиболее хорошо изученным представителем группы белковых факторов роста (мито- и мотогенов) является тромбоцитраный фактор роста (PDGF). Несмотря на огромное количество данных, накопленных с момента открытия PDGF, теории, объясняющей большинство его эффектов в живом организме, не существует - поэтому новые и новые исследования приносят новые и новые результаты [18].
Человеческий PDGF, выделенный из тромбоцитов, представляет собой гетеродимер. Две различные цепи (обозначаемые А и В), входящие в его состав, соединяются дисульфидными связями. В виде минорных компонентов сывороточного PDGF встречаются также гомодимерные молекулы, однако форма АВ является у человека преобладающей.
Концентрация PDGF в кровяной сыворотке поддерживается на постоянном уровне 50-60 нг/мл, в плазме, не содержащей тромбоцитов, PDGF не обнаружен. Эксперименты с меченым белком показали, что время жизни его в сыворотке сравнительно мало: период полураспада примерно равен 2 мин. Постоянная концентрация поддерживается, по-видимому, эа счет непрерывного высвобождения из тромбоцитов.
PDGF индуцирует хемотаксис лейкоцитов, гранулоцитов, макрофагов, для стимуляции их направленного движений достаточно внешней концентрации PDGF 1-2 нг/мл.
Далее в процесс вовлекаются клетки соединительной ткани, ответственные за образование рубца: стимулируются пролиферация фибробластов и их направленное перемещение, а также синтез и секреция белков внеклеточного матрикса.
Семейство трансформирующих факторов роста (TGF) включает более 40 различных членов, сгруппированных в несколько подсемейств. Оно включает также активины, ингибины и другие цитокины.
TGF-β - мощный стимулятор выработки коллагена.
TGF-α стимулирует фибробласты, развитие эндотелия, является ангиогенным фактором. Как и эпидермальный фактор роста, TGF-α участвует в регуляции пролиферации клеток.
Теоретические аспекты морфологических и биохимических изменений.
Тромбоциты запускают природные механизмы самовосстановления, регенерации и лечения, стимулируя рост и деление новых здоровых клеток.
Активация тромбоцитов приводит к изменению дисковидной формы тромбоцитов на сферическую, образованию у них отростков (псевдоподий тромбоцитов), адгезии тромбоцитов к субэндотелиальным структурам, в частности к коллагену. Результатом активации являются также начальная агрегация тромбоцитов и высвобождение из них ряда веществ, служащих сильными стимуляторами тромбоцитов (АДФ, серотонин, адреналин, нестабильные простагландины, тромбоксан А2, тромбоцитоактивирующий фактор).
В рыхлой соединительной ткани постоянно находятся клетки, являющиеся потомками стволовой кроветворной клетки. Это гистиоциты-макрофаги, антигенпредставляющие клетки, тканевые базофилы (тучные клетки), плазмоциты, клетки крови (гранулоциты, моноциты, лимфоциты).
Гистиоциты-макрофаги составляют 10-20% от всего клеточного состава рыхлой соединительной ткани. Особая разновидность макрофагов принимает участие в качестве антигенпредставляющей клетки и тем самым являются участниками кооперации Т- и В-лимфоцитов при иммунном ответе на чужеродные вещества. Макрофаги нейтрализуют токсины, могут накапливать витальные красители при введении их в кровь. Они проявляют антибактериальные свойства, выделяя лизоцим, кислые гидролазы, лактоферрин и др., обладают антиопухолевой активностью, выделяя фактор некроза опухолей. Факторы роста макрофагов влияют на пролиферацию эпителиальных клеток, пролиферацию и дифференцировку фибробластов, новообразование кровеносных сосудов и др.
Способность к фагоцитозу является общебиологическим свойством многих тканевых клеток. Однако только те клетки, которые способны захватывать и ферментативно перерабатывать в своей цитоплазме бактерии, инородние частицы, токсины и др., следует относить к макрофагической системе организма.
Тканевые базофилы (тучные клетки, лаброциты, гепариноциты) — развиваются из стволовых кроветворных клеток. Наиболее характерный признак тучных клеток — это наличие в цитоплазме многочисленных гранул, диаметр которых 0,3-0,7 мкм, обладающих свойством метахромазии (окрашиваться не в цвет красителя). В гранулах содержатся гепарин, гистамин, хондроитинсульфаты, гиалуроновая кислота, серотонин, хемотаксические факторы для эозинофильных и нейтрофильных гранулоцитов и др. При дегрануляции тучных клеток выделяется гепарин, препятствующий свертыванию крови. Выход биогенных аминов сопровождается изменением проницаемости гематотканевого барьера. Кроме того, тучные клетки вырабатывают цитокины, участвующие в иммунных процессах.
Материалы и методы.
С 2006 по 2010 год было проведено лечение 280 пациентов с жалобами на выпадение волос (210 (75%) - женщин, 70 (25%) - мужчин), возраст пациентов варьировал от 15 до 72 лет.
Критериями исключения пациентов из исследования являлись:
I. Системные заболевания крови
II. Аллергические реакции на антикоагулянты
III. Наличие злокачественных новообразований
IV. Сахарный диабет в декомпенсированной форме
V. Дерматозы в стадии обострения
VI. Соматическая патология в стадии обострения
У всех пациентов собирался анамнез, проводился общий клинический анализ крови, коагулограмма (содержание фибриногена), биохимический анализ крови.
Для получения БоТП используют центрифугу EBA 20 производства Andreas Hettich GmbH & Co. Германия. Регистрационное удостоверение ФС № 2009/04309.
Забор крови осуществляют с помощью периферического венозного катетера диаметром не менее 19G, чтобы не повредить форменные элементы крови. Кровь помещается в стандартную стерильную пробирку типа vacuette или подобную с антикоагулянтом, имеющую разрешение к использованию в РФ.
Кровь забирается в объёме 36 мл, что соответствует 4 пробиркам vacuette по 9 мл. Далее пробирки укладываются в центрифугу.
В ходе вращения кровь разделяется на три основных составляющих по степени плотности. Наименее плотная бедная тромбоцитами плазма (БеТП) отделяется первой, богатая тромбоцитами плазма (которую иногда называют «тромбоцитарно-лейкоцитарным» слоем) отделяется во вторую очередь, и наиболее плотные эритроциты отделяются последними. БоТП представляет собой плазму с высоким содержанием тромбоцитов и лейкоцитов. Ее объем составляет около 6 мл.
И богатая, и бедная тромбоцитами плазма являются фракциями крови и содержат большое количество фибриногена и других факторов свертывания.
Богатая тромбоцитами плазма забирается шприцем, оставшиеся фракции крови утилизируются в соответствии с санитарными нормами РФ.
Впервые инъекционная форма БоТП была применена в 2005 году [5].
Идея инъекционной формы БоТП, позволила «вернуться» к технике инфильтрации тканей компонентами крови, но в более безопасной и гораздо менее болезненной форме. Более того, вопрос концентрации тромбоцитов дополнительно решается простым увеличением объёма инфильтрата [10].
При выпадении волос введение БоТП проводится без предварительной инициации процесса свертывания, вводится в скальп инъекционно, из расчета 0,5 мл БоТП на 2 см2 поверхности, стерильным шприцем после обработки антисептиками на водной основе, с использованием мезотерапевтической техники введения растворов.
Возможным осложнением введения БоТП может явиться аллергическая реакция, которая устраняется согласно протоколу борьбы с аллергическими реакциями немедленного типа в условиях медицинского учреждения.
Обычно лечение применяется курсом в 4 - 5 процедур с интервалом между ними 7–10 дней, перерыв между курсами 6 месяцев.
Результаты и их обсуждение.
Результаты терапии состояний, сопровождающихся повышенным выпадением волос, оценивались после одного-двух курсов процедур.
При лечении состояния повышенного выпадения волос, прекращение выпадения волос может отмечаться с 5-6 суток, эффект длится до 6-8 месяцев, к концу курса отмечается отрастание новых, общее их укрепление и появление блеска.
Данные наблюдения подтвердились после проведения исследований плотности и диаметра волос.
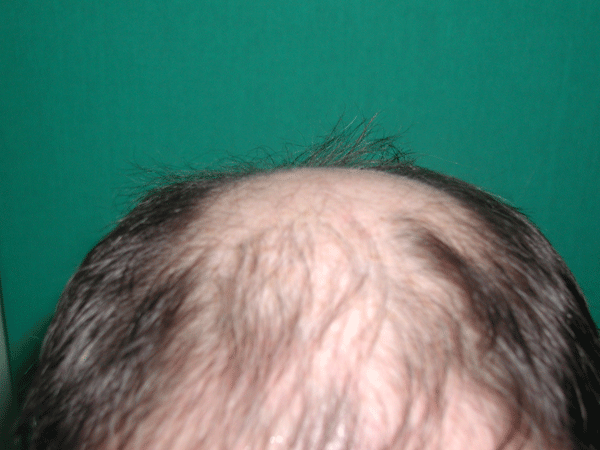
В случае алопеции рост волос наблюдается через 10 – 14 недель.
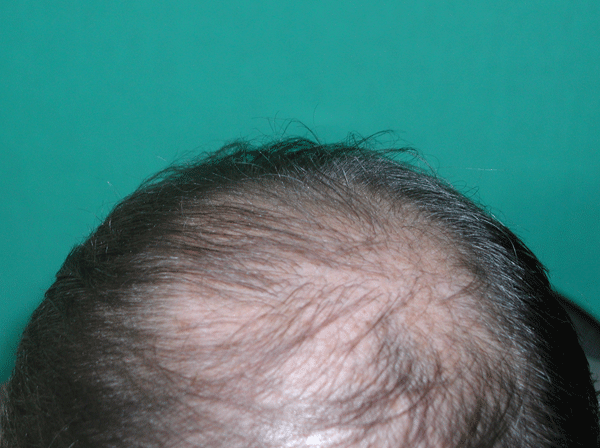
Рис. 2 Состояние волосистой части головы после 5 инъекций БоТП
Таким образом, одновременно нормализуется клеточный метаболизм, улучшается кровоснабжение и питание волосяных луковиц, и постепенно полностью останавливается их выпадение.
Данное утверждение и объясняет рост коллагеновых и эластических волокон, отвечающих за упругость кожи, и провоцируют рост волосяного покрова головы.
Согласно полученным данным, стимуляция волосистой части головы инъекциями БоТП вызывает усиление роста волос и улучшает внешний вид волос (появление блеска).
Морфологическое исследование биоптата кожи кроликов
В качестве экспериментальной модели была выбрана кожа кроликов вида Советская Шиншилла.
Всего было обследовано 25 кроликов. Оба бока обрабатывались, брились, в один бок вводилась БоТП, в другой бок кролика ничего не вводилось.
На 7ые сутки проводилась биопсия кожи.
Согласно данным гистологического исследования биоптата кожи после введения БоТП морфологические признаки выраженного воспаления отсутствуют. Некоторое повышение плотности клеточных элементов в сосочковом слое дермы кожи между волосяными фолликулами может быть реакцией ткани на механическую травму от иглы, при помощи которой была сделана инъекция. В более глубоких слоях кожи, а именно в сетчатом слое дермы, определяются крупные веретеновидные фибробласты и гистиоциты с крупными округлыми ядрами – макрофаги соединительной ткани.
Встречающиеся капилляры спокойные, без признаков нарушения структуры и функции.
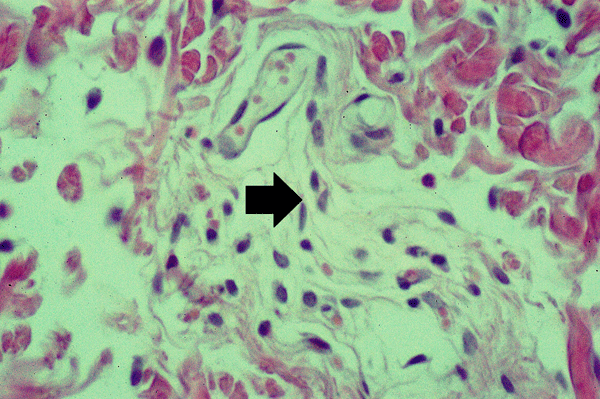
(стрелкой показано скопление гистиоцитов)
1. Результатом аутостимуляции тканей является активная регенерация, метод может быть эффективен в лечении состояний, сопровождающихся повышенным выпадением волос.
2. Инъекционная форма введения БоТП удобна и малотравматична при использовании.
3. Стимуляция волосистой части головы инъекциями БоТП вызывает усиление роста волос и улучшает внешний вид волос.
Литература:
1. Wilson J.D., Foster D.W. Williams Textbook of Endocrinology, 8th edition, Philadelphia, 1992.
2. Whiting D.A. Possible mechanisms of miniaturization during androgenetic alopecia or pattern hair loss. J Am Acad Dermatol.2001;45:3:81-6.
3. Trueb R. Diffuse hair loss in men and women. Hair Newsletter. 2004;1:6-14.
4. Haynesworth SE, Goshima О, Goldberg VM, Caplan AI Characterization of cells with osteogenic potential from human marrow, Bone, 1992;13(1):81-8.
5. Зарудий Р.Ф., Ахмеров Р.Р. Электронный журнал «Регенеративная хирургия», УДК 616.5-085:615.38, 2005. №3
6. Ахмеров Р.Р. Магнитно-резонансные характеристики тканей при острых одонтогенных воспалительных заболеваниях, дис. канд. мед. наук, Казань, 1998
7. «Плазмолифтинг – гемологическое армирование кожи: новый взгляд на решение старой проблемы», доклад 25.11.2010, Иерусалим, I Международная научно-практическая конференция «Актуальные вопросы в косметологии: традиционные и новые подходы в эстетической медицине»
8. Ахмеров Р.Р. , Зарудий Р.Ф., Рычкова И.Н., Исаева М.Г., Алтыева А.Ф. «Аутостимуляция регенеративных процессов в челюстно-лицевой хирургии и косметологии», X международный симпозиум по эстетической медицине
9. Разрешение на применение новой медицинской технологии от 26.10.2010 ФС №2010/380 «Аутостимуляция регенеративных процессов при лечении пародонтита и атрофических состояний мягких тканей средней зоны лица»
10. Davis JC, Buckley CJ, Per-Olof B. Compromised soft tissue wounds: Correction of wound hypoxia. In: Hunt TK (ed). Problem Wounds: The Role of Oxygen. New York: Elsevier, 1988:143-152.
11. Johnson K, Hunt TK, Mathes SJ. Oxygen as an isolated variable influences resistance to infection. Ann Surg 1988;208:783-787.
12. Hunt TK, Allen O, Zabel D, Knighton DR. Defenses of the wound. In: Simmons RL, Howard RJ (eds). Surgical Infectious Disease. New York: Appleton-Lange.
13. Knighton D, Silver I, Hunt TK. Regulation of wound healing angiogenesis—Effect of oxygen gra¬dients and inspired oxygen concentration. Surgery 1981;90:262-270.
14. S.Mohan S, Baylink DJ. Bone growth factors. Clin Orthop Relat Res 1991;263:30-43.
15. Wergedal JE, Mohan S, Lundy M, Baylink DJ. Skeletal growth factor and other factors known to be present in bone matrix stimulate proliferation and protein synthesis in human bone cells. J Bone Miner Res 1990;5:179-186.
16. Marx RE. Radiation injury to tissue. In: Kindwall ER (ed). Hyperbaric Medicine Practice. Flagstaff, AZ: Best Publishing Company, 1994:447-504.
17. Hussain MZ, LaVan F, Hunt TK. Wound micro-environment. In: Cohen IK, Diegelman R (eds). Wound Healing: Biochemical and Clinical Aspects. Philadelphia: Saunders, 1991:162-196.
18. Lacci KM, Dardik A. Platelet-rich plasma: support for its use in wound healing. In: Yale О Biol Med, 2010, 83(1) : 1-9.
